Ejemplos ilustrativos - Estudio clínico del
CLAP
La Figura 2 (ver Ejemplo de resumen de todo el personal que
participará en la recolección de datos) muestra un
resumen de todo el personal que participará en la
recolección de datos. Todos los hospitales recibirán una
computadora que se utilizará únicamente para el manejo de
datos y que operará el administrador de datos. Los hospitales
del grupo intervención recibirán una segunda computadora,
que será utilizada por las personas encargadas de atender partos
con fines diferentes a la recolección de datos para los
resultados primarios y secundarios. Sin embargo, se utilizará
para recopilar datos sobre ciertas medidas de proceso, sólo en
los hospitales del grupo intervención.
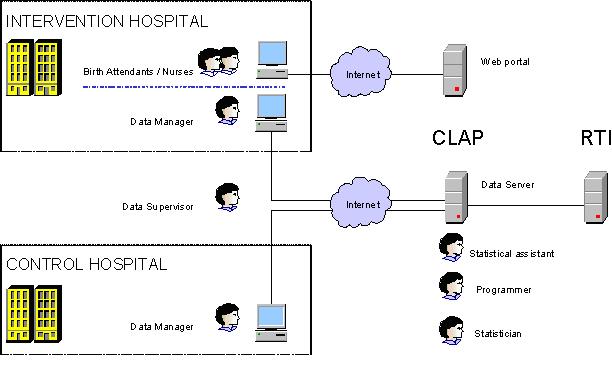
El sistema de recolección de datos se coordinará
en forma centralizada en el CLAP, y estará a cargo de un
estadístico. El equipo del CLAP incluirá un programador,
un asistente de estadística y dos encargados del ingreso de
datos. El programador del CLAP desarrollará el software para la
recolección y validación de datos. El asistente de
estadística llevará a cabo actividades diarias de manejo
de datos (comunicación con el supervisor de datos y con los
encargados del ingreso de datos en los hospitales, producción de
informes de monitoreo y validación, etc.). Dos encargados del
ingreso de datos ingresarán en forma independiente los
formularios en papel que se envían al CLAP. Dos supervisores de
datos en Argentina y un supervisor de datos en Uruguay pondrán
en práctica y supervisarán la recolección de datos
a nivel nacional durante todo el período del estudio. Por lo
general, los supervisores de datos visitarán los hospitales
semanalmente, aunque la frecuencia de las visitas puede variar
según el desempeño y las necesidades de cada hospital. Se
contratará un administrador de datos por hospital. En la
mayoría de los casos, este puesto lo ocupará un empleado
del hospital que trabajará media jornada para el proyecto.
Se recolectarán datos clínicos en cuatro etapas, con un
año de diferencia entre una y otra (ver Ejemplo de cronograma
para la recolección de datos):
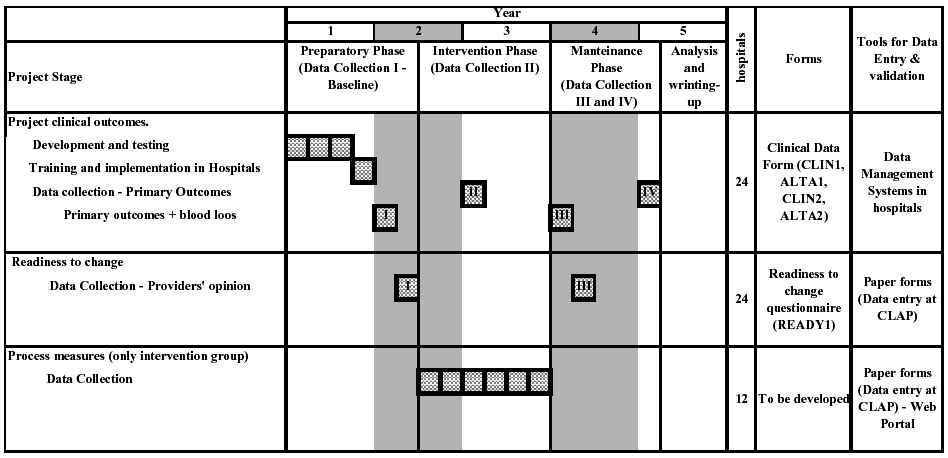
Etapa I. Recolección de datos basales: antes de la
aleatorización en la etapa preparatoria, para los resultados
primarios y secundarios.
Etapa II. Recolección de datos durante la intervención:
inmediatamente antes de la puesta en práctica de las normas,
sólo para resultados primarios.
Etapa III. Recolección principal de datos luego de la
intervención: inmediatamente después del componente de
mantenimiento de la intervención, para resultados primarios y
secundarios.
Etapa IV. Segunda recolección de datos luego de la
intervención: Un año después de la
recolección principal de datos luego de la intervención,
sólo para los resultados primarios.
Administración de cuestionarios
Datos clínicos
Los datos serán copias con papel carbónico de
los registros clínicos.
Cuestionarios para las personas encargadas de atender partos
Se les entregarán cuestionarios a todos los encargados de
atender partos en los hospitales participantes antes de la
aleatorización (inmediatamente después de la Etapa I) y
después del término de la intervención
(inmediatamente después de la Etapa III).
Recolección de muestras biológicas
Medición de la cantidad total de pérdida de sangre (ml)
Las enfermeras, las parteras y los médicos que integran
los equipos que atienden los partos en los hospitales participantes
recibirán capacitación en la medición de
pérdida de sangre postparto. Las enfermeras y las parteras
serán las principales responsables de las mediciones. Tanto los
coordinadores de campo como los supervisores de recolección de
datos se encargarán de la capacitación. Se llevará
a cabo un estudio piloto en el hospital piloto de Montevideo (Pereira
Rossell) con el objeto de evaluar la aceptabilidad de la técnica
de medición.
Entrenamiento del personal del estudio para la recolección de datos
El entrenamiento se realizará durante la etapa
preparatoria, junto con otras actividades. Esta etapa durará
alrededor de 18 meses. El administrador de datos coordinará el
entrenamiento en los procedimientos de recolección de datos. El
estudio piloto del manual de operaciones de recolección de datos
y formularios de recolección de datos se realizará en un
hospital en Montevideo, Uruguay y en un hospital en Buenos Aires,
Argentina. Estos hospitales no se aleatorizarán, pero
serán similares a aquéllos que se asignarán a los
grupos intervención y control.
Entrenamiento de los encargados de la recolección de muestras biológicas
Las enfermeras y las obstétricas de la sala de partos de cada hospital recibirán capacitación sobre cómo medir la cantidad total de sangre perdida en partos vaginales. Se las entrenará para realizar esta medición como actividad de rutina en todos los partos vaginales durante las etapas de recolección de datos. Los supervisores de datos y los coordinadores de campo se encargarán de las actividades de entrenamiento y suministrarán a los hospitales las bolsas estándar de medición.
(Estudio clínico del CLAP - ver el protocolo)
 Lista de
verificación para la recolección de datos
Lista de
verificación para la recolección de datos Diseño de
cuestionarios: realizar preguntas con un propósito determinado
Diseño de
cuestionarios: realizar preguntas con un propósito determinado